Dacă ne fixăm numărul de A, Z, și nu se va lua în considerare structura internă a nucleului atomic, obținem un anumit tip de atomi, și anume, un anumit nuclid. A nu se confunda concepte „izotopi radioactivi“ și „nucleon“: ambele cuvinte sunt derivate din latinescul „nucleul“ - „miez“, dar nucleon - o particulă compusă din miez, iar izotopului - este genul de atomi cu o compoziție dată a nucleelor (protoni Z, N neutroni ).
Natura chimică a norului de electroni unui atom este specificat, iar compoziția sa depinde de sarcina nucleară, adică numărul tuturor atomilor Z. Prin urmare, unul dintre natura chimică a nucleului au aceeași sarcină. Prin urmare, elementul chimic - o colecție de atomi cu o valoare predeterminată Z. taxa nucleară număr Z este motivul pentru care a fost numit număr atomic, ca și în elementele tabelului periodic sunt aranjate în Z. ascendentă
Dacă numărul nuclides masă diferite A, dar au același număr atomic Z, atunci ele au aceeași natură chimică, aparțin unuia și aceluiași element și sunt izotopi ai acelui element. Pentru a desemna un izotop specific al unui simbol element chimic atribut top număr stânga A, de exemplu:
hidrogen element chimic
După cum arată tabelul, există hidrogen naturale sub formă de trei izotopi, cu simbolul chimic acolo, chiar proprii pentru deuteriu și tritiu.
Dar nu orice set de protoni și neutroni poate da un nucleu atomic stabil. Se întâmplă că miezul este capabil să se dezintegreze spontan, transformându-se într-un nucleu diferit. Acest fenomen se numește radioactivitate. iar procesul de degradare este de obicei urmata de radiatii - radiații.
(Despre 250)
Ecuațiile ecuații radioactive descompuse sunt scrise ca și reacții chimice. De exemplu, un atom de tritiu dezintegrează într-3 heliu ioni, electroni și particula particular, care se numește antineutrino de electroni:
Cu toate acestea, să fie conștienți de faptul că descompunerea radioactivă nu este un proces chimic. pentru că atunci când există o transformare mutuală a nucleelor atomice.
Majoritatea radionuclizi nu a fost găsit în natură și produse în mod artificial. Stabilitatea lor este de obicei caracterizată printr-un timp de înjumătățire t1 / 2 - un interval de timp în care probabilitatea de colaps a nucleului este de 50%. Timpul de înjumătățire plasmatică poate varia de la câteva fracțiuni de secundă trilioane la mai multe mii de miliarde de ani.
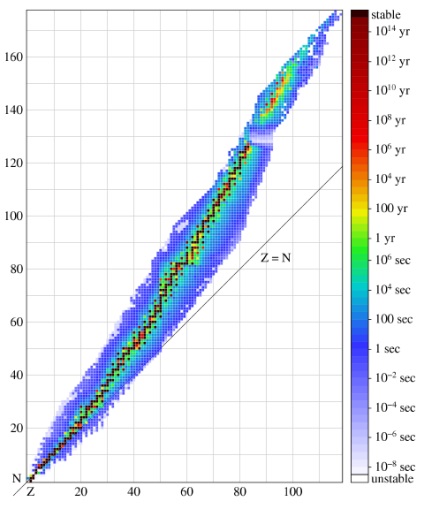
Această figură arată o nuclizi diagramă. în care în coordonatele (Z, N) mapate nuclide cunoscute; pătrate de culoare depinde de stabilitatea nuclid, în conformitate cu scala de pe dreapta de înjumătățire. Fiecare coloană din această diagramă corespunde unei anumite valori și Z reprezintă un set de izotopi ai unui element chimic.
Este interesant de știut! Lanțul îngust nuclidele mai stabile corespunde raportului optim de neutroni și protoni. Pentru o masă dată de ea poate fi exprimată prin formula
N / Z = 1 + 0,015 A 2/3
Pentru valori mici ale numărului de masă Un raport de N / Z este obținut aproape de unitate, astfel încât elementele comune printre primii izotopi, în care N = Z. Dar atunci neutroni devine mai mare, și, de exemplu, izotopi stabili de plumb numărul lor depășește numărul de protoni este de aproximativ jumatate ori.
Izotopii elementelor chimice au aceleași proprietăți chimice. astfel încât acestea nu pot fi distinse prin mijloace chimice. În natură, procese foarte rare care afectează nuclee și diferiți izotopi ai aceluiași element se comportă similar în natură, formează același compus și se amestecă astfel unele cu altele. Ca urmare, raportul izotopilor este practic independentă de teren, din care elementul și este aproximativ aceeași de-a lungul întregii planete. Acest raport se numește izotopii de compoziție izotopică naturală a elementului.
msredn. = 0.76 · 35 · + 0,24 = 37 35.5 amu
Atomii de diferiți izotopi au mase diferite, dar constanța compoziției izotopice a condus la faptul că valoarea medie a masei unui atom al elementului constant. Este în medie pe valoarea izotopii naturale, exprimată în unități atomice de masă (amu), o masă atomică relativă Ar acest element. In tabelul periodic masele atomice relative date pentru elementele obținute din surse naturale.
Numărul lui Avogadro (6,02 # 0183, 10, 23) amu exact egal un gram. Cu toate acestea, dacă masa unei particule în medie unitățile atomice Ar, masa unui mol de astfel de particule atinge grame Ar. De exemplu, m (1 mol de atomi de Cl) = 35,5 g
atom particular de masă exprimată în uam foarte aproape de numărul său O masă, deoarece masa unui nucleon este aproximativ egală cu 1 amu dar numai în atom A nucleonilor. Prin urmare, în cazul în care predominant natural oricare izotop al elementului, valoarea Ar acest element va fi aproape de numărul de masă al izotopului predominant. De aceea, greutatea atomică relativă a numeroase elemente aproape de numere întregi. Cu toate acestea, pentru a nu fi valori confuze A și Ar. Un număr caracterizează un nuclid specific și indică cât de mult nucleonilor în nucleu, iar numărul Ar caracterizează un set de izotop natural al unui element chimic, iar valoarea medie indică masa atomului elementului din amu