Apa ca solvent de solubilitate.
oxid de hidrogen (H2O) - - Apa una dintre substanțele cele mai comune și importante. Apă pură în natură - conține întotdeauna impurități. Apa pură obținută prin distilare. apă distilată se numește distilat. Conținutul de apă (în greutate): 11,19% hidrogen și 88.81% oxigen. Apa pură este limpede, inodor și fără gust. Ea are cea mai mare densitate de la 0 ° C (1 g / cm3). Densitatea de gheață mai mică decât densitatea apei lichide, astfel încât gheața plutește la suprafață. Apa îngheață la 0 ° C și se fierbe la 100 ° C sub o presiune de 101 325 Pa. Ea este un conductor slab de căldură și un conductor foarte slab de energie electrică. Apa - un solvent bun. Molecula de apă are o forma unghiulara atomii de hidrogen cu oxigenul pentru a forma un unghi de 104,3 °. Prin urmare, o molecula de apa - dipol: acea parte a moleculei în care este hidrogen, este încărcată pozitiv și porțiunea în care oxigenul - negativ. Datorită polarității moleculelor de apă sunt disociate în ioni electroliți în acesta. Apa lichidă împreună cu moleculele de H2O uzuale continute molecule asociate, adică. E. Combinat în agregate mai complexe (H2O) x datorită formării legăturilor de hidrogen (Fig. 4). Prezența legăturilor de hidrogen dintre moleculele de apă sunt explicate prin anomalii în proprietățile sale fizice: densitatea la maxim 4 ° C, punct de fierbere ridicat (într-o serie de H2O - H2S - N2Se) capacitate anormal de mare de căldură (4,18 kJ / (g • K)). Cu creșterea temperaturii, legăturile de hidrogen sunt rupte, iar ruperea completă are loc la trecerea apei în abur.
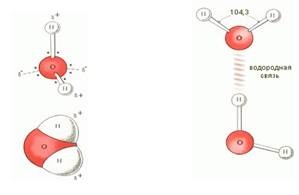
Figura 4. Molecula de apă
Soluții - sistem multicomponent omogen format dintr-un solvent, soluților și produsele lor de reacție. Starea de agregare pot fi soluții lichide (apă de mare), gazos (aer) sau solide (mai multe aliaje metalice). dimensiunile particulelor în soluții adevărate - mai puțin de 10-9 m (aproximativ dimensiunile moleculare). Dacă particulele moleculare sau ionice distribuite în soluția lichidă sunt prezente în el într-o astfel de cantitate încât în aceste condiții nu dizolvare ulterioară a substanței, numită o soluție saturată. (De exemplu, dacă am pus 50 g de clorură de sodiu în 100 g H2O, apoi dizolvat la 200C doar 36 g de sare).
Se numește o soluție saturată, care este în echilibru dinamic cu exces solutului. Se obține plasarea 100 grame de apă la 200C mai mică de 36 g soluție de NaCI nesaturate. După încălzire, amestecul de sare cu apă până la dizolvarea 1000C produce 39,8 g NaCl în 100 g apă. Dacă acum îndepărtați sarea insolubilă din soluție, iar soluția a fost răcită cu atenție la 200C, o cantitate în exces de sare nu este întotdeauna precipitat. În acest caz, avem de-a face cu o soluție suprasaturată. Solutia suprasaturată este foarte instabilă. Amestecând, agitare, se adaugă granule de sare poate cauza cristalizarea sării în exces și trecerea la starea stabilă saturată. soluție Nesaturați - o soluție care conține o substanță mai mică saturate. soluție suprasaturată - o soluție care conține substanțe mai mari decât saturate.
Soluțiile formate prin interacțiunea unui solvent și solut. Procesul de interacțiune a Solvarea solvent și solutului numit (în cazul în care solventul este apa - hidratare). Dizolvarea are loc pentru a forma diferite forme și produse Forța de aderență - hidrat. Atunci când această forță implicată atât de natură fizică și chimică. Procesul de dizolvare ca urmare a acestor componente interacțiuni însoțite de diferite fenomene termice. dizolvare a energiei caracteristic este căldura de formare a soluției, considerată ca suma algebrică a efectelor termice ale endo - și etape ale procesului exoterme. Cele mai importante dintre acestea sunt:
- procesele de absorbție de căldură - distrugerea rețelei cristaline, rupe legaturile chimice din molecule;
- procese termice generatoare - formarea produselor de interacțiune a solutului cu solvent (hidrați) și altele.
Dacă energia de rupere a rețelei cristaline este mai mică decât energia de hidratare a solut, dizolvarea merge cu eliberarea de căldură (se observă încălzirea). Astfel, dizolvarea NaOH - proces exoterm: distrugerea rețelei cristaline este irosită 884 kJ / mol, iar formarea ionilor hidratați Na + și OH - alocate, respectiv 422 și 510 kJ / mol. Dacă energia de cristal energie zabrele de hidratare mai mare, dizolvarea are loc cu absorbție de căldură (în prepararea de scădere a temperaturii soluției apoase NH4NO3 este observată).
Solubilitatea. Rezerva de solubilitate a multor substanțe în apă (sau alți solvenți) reprezintă o valoare constantă care corespunde concentrației unei soluții saturate la o temperatură dată. Este o solubilitate caracteristică calitativă și în referințele conținute în grame per 100 g de solvent (în anumite condiții). Solubilitatea depinde de natura solutului și solventului, temperatura și presiunea.
1. Natura solutului. substanțele cristaline sunt împărțite în:
P - foarte solubil (mai mult de 1,0 g la 100 g de apă);
M - ușor solubil (0,1 g - 1,0 g la 100 g de apă);
H - insolubil (mai puțin de 0,1 g la 100 g de apă).
2. Natura solventului. Când formarea legăturii dintre particulele din soluția fiecărei componente sunt înlocuite cu legături între particule de diferite componente. Pentru noi conexiuni pot fi formate, componentele de soluție trebuie să aibă același tip de conexiune, de ex., E. să fie de aceeași natură. substanțe ionice De aceea solubili în solvenți polari, și slab în nepolară și substanțele moleculare - vice-versa.
3. Efectul temperaturii. Dacă solutului este un proces exoterm, apoi cu creșterea temperaturii solubilitatea scade (de exemplu, Ca (OH) 2 în apă) și vice-versa. Pentru majoritatea sărurilor caracteristice cresc solubilitatea sub încălzire (fig. 5). Practic toate gazele sunt dizolvate exoterm. Solubilitatea gazelor în lichide scade odată cu creșterea temperaturii și cu creșteri descrescătoare.
4. Efectul presiunii. Odată cu creșterea presiunii solubilitatea gazelor în lichide crește și scade odată cu scăderea.
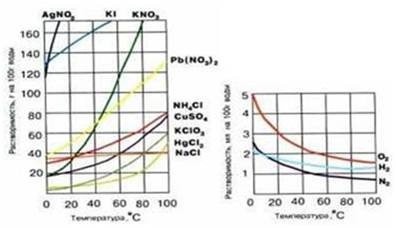
Figura 5. Dependența de substanțe de solubilitate a temperaturii