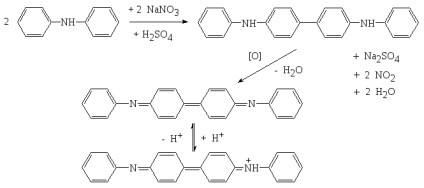
azotat de sodiu, azotat de sodiu, azotat de Chile
nitrat de sodiu (Chile salpetru) NaNO3. Cristale incolore au fost trigonal sau romboedric. Rețeaua cristalină a CaCO3 calcit. Punct de topire = 308 ° C, o densitate de 2,26 g / cm 3. higroscopic, ușor solubil în apă. Planșele oxidante proprietăți. Conductivitatea molară la diluție infinită la 25 ° C este egală cu 121.56 See. cm2 / mol.
De obicei, există impurități halogenuri, principalele depozite în Chile (Tarapaca și provincia Antofagasta). Alb, galben, roșu, maro, gri. Duritatea pe scara Mohs 1,5-2;. Densitate 2,3 g / cm. Formată în principal din cauza activității vulcanice sau oxidarea azotului. Higroscopice.
răspuns analitic la cationul de sodiu.
1. Reacția cu acetat de dioxouranium (VI) Zn Zinc (UO2) 3 (CH3COO) 8 c formează un solid cristalin galben (reacție farmacopeică - GOR) sau cristale galbene tetra-, formă octaedru, insolubilă în acid acetic (ISS). Pentru a mări sensibilitatea amestecului de reacție trebuie încălzit în studiu pe diapozitiv.
NaCl + Zn (UO2) 3 (CH3 COO) 8 + CH3COOH + 9 H2O
Interferențe: ionii in exces K +. cationi de metale grele (Hg2 2+. Hg 2+. Sn 2+. Sb 3+. Bi 3+. Fe 3+ etc.). Reacția este folosită ca fracțională după îndepărtarea cationilor de interferență.
2. Colorarea flacără incolor în galben (GF).
3. Reacția cu acid picric pentru a da cristale de sodiu picrat galben în formă de ace, pornind de la un punct (ISS).
Eroare: Sursa de referință nu a fost găsit
Reacția este folosită ca fracționată numai în absența ionilor de interferență (K +. NH4 +. Ag +).
4. Reacția cu geksagidroksostibatom (V) de potasiu K [Sb (OH) 6] pentru a da un precipitat alb cristalin, care este solubil în alcalii.
NaCl + K [Sb (OH) 6]
Condiții de reacție: a) o concentrație suficientă de Na +; b) o soluție de reacție neutră; c) efectuarea reacției în frig; d) frecare cu o baghetă de sticlă pe partea laterală a tubului. Interferențe: NH4 +. Mg 2+ și alte.
Într-un mediu acid reactiv este distrus cu formarea unui precipitat alb amorf de acid metasurmyanoy HSbO3.
K [Sb (OH) 6] + HCI
H3 SbO4
răspuns analitic la ion nitrat.
1. difenilamină într-un mediu de H2 SO4 concentrat (GF).
Difenilamină oxidat mai întâi cu acid azotic în incolor N, N-difenilbenzidin, apoi „difenilbenzidin violet“:
Metodologie: vas de porțelan uscat (creuzet) este plasat cristal difenilamină a fost adăugat câteva picături de concentrat H2 SO4 și 1-2 picături de soluție conținând ion nitrat. O culoare albastru intens. Reacția este sensibil, dar nu specifică. Prevenirea oxidanți - NO2 -. Fe 3+. MnO4 - etc. și Reducători - S 2-. SO3 2-. S2 O3 2-. I - și altele.
2. Cu cupru metal într-un mediu de H2 SO4 concentrat (GF).
2 NaNO3 + Cu + H2 SO4 2
Metodologie: Substanța uscată (0.002-0.005 g de ion nitrat), se adaugă 2-3 picături de apă și acid sulfuric concentrat, o bucată de metal de cupru este încălzit și se alocă fumului brun de oxid de azot (IV).
3. sulfatul de fier (II).
NaNO3 + 2 6 FeSO4 + 4 H2 SO4
NO + FeSO4
Metodologie: 2 pentru a testa prin picurare, soluție de nitrat în cristal rece de FeSO4 a fost adăugat cu precauție, iar tuburile de perete concentrat H2 SO4. inel Brown observat datorită formării sulfat nitrozozheleza (II) [Fe (NO)] SO4. Împiedicați I -. Br -. și anioni-oxidanți.
4.C antipirina într-un mediu de acid sulfuric concentrat pentru a forma nitroantipirina roșu.
Metodologie: porțelan ceașcă uscată 2 este plasată o picătură de soluție de testare se adaugă 1 picătură de soluție apoasă 5% de antipirinei și 4-8 picături de acid sulfuric concentrat, se agită ușor. Urmărirea colorația roșu intens, diluarea ulterioară cu apă conduce la o tranziție în roșu carmin culoare roșie.
5. Soluție KMnO4 în acid sulfuric (HF). Nonvanishing colorație roz observată a soluției (spre deosebire de NO2 - soluție KMnO4 anioni înălbitor).
NO3 Detection - -ion reacțiile cu sulfat de difenilamină și fier (II) împiedică prezența NO2 - -ion, prin urmare, necesar să se cunoască metodele de distrugere a ioninitrit.